Yükseltgenme-İndirgenme ( Redoks) Tepkimeleri
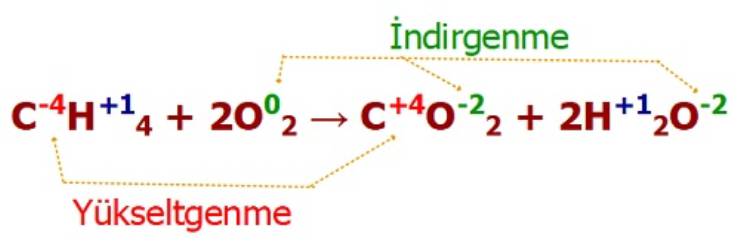
Elektron alış-verişinin olduğu tepkimelere yükseltgenme-indirgenme yada redoks tepkimeleri denir.
Yükseltgenme Bir maddenin elektron vermesi olayıdır.
Zn0 –> Zn+2 + 2e- burada Zn0 dan Zn+2 ye 2 e- vererek yükseltgenmiştir.
İndirgenme Bir maddenin elektron alması olayıdır.
Cu+2 + 2e- –> Cu0 Cu0 bu olayda Cu+2′ den 2e- alarak Cu0 a indirgenmiştir.
*Bu iki tepkimenin tek başına olması imkansızdır. Redoks tepkimelerinde mutlaka en az bir indirgenen ve birde yükseltgenen madde olmalıdır.
5Fe+2 + MnO4-1 + 8H+ –> 5Fe+3 + Mn+2 + 4H2O
yükseltgenme indirgenme yükseltgenme indirgenme
Yukarıdaki tepkime incelendiği zaman Fe+2 iyonu Fe+3 iyonuna yükseltgenirken Mn+5 iyonu da 3 elektron alarak Mn+2 iyonuna indirgenmiştir. Burada Fe+2 iyonu indirgendir; Çünkü Mn+5 iyonunu Mn+2 iyonuna indirgemiştir. MnO4- iyonu ise yükseltgendir; Çünkü Fe+2 iyonunu Fe+3 iyonuna yükseltgemiştir.
*Yukarıdaki ifadeye göre yükseltgenen madde inidirgen, indirgenen madde yükseltgen özellik gösterir diyebiliriz.
* Elektron veren madde yükseltgenir.(indirgendir)
* Elektron alan madde indirgenir.(yükseltgendir)
* En iyi elektron veren ¤¤¤¤ller en aktiftir.
Pil Redoks tepkimelerinin elektrik enerjisi üretebilecek şekilde düzenlenmesiyle yapılmış sistemlere elektrokimyasal pil denir. Elektronun akış yönü
Zn Cu
Anot Katot
(elektrot) (elektrot)
1 M Zn+2 1 M Cu+2
Tuz köprüsü
Elektrot Yükseltgenme ve inidirgenme olaylarının olduğu kısımlardır.
Elektrolit Elektrik akımını ileten iyonik çözeltilerdir. Yukarıdaki pilde Zn+2 ve Cu+2 çözeltileri birer elektrolittirler.
Yukarıdaki pilin çalışabilmesi için anottan katota sürekli bir elektron akışının sağlanması gerekir. Burada Zn(k) çubuğun çözünerek Zn –> Zn+2 + 2e- Zn elektron verecek ve zamanla Zn çubuğun kütlesi azalacak, 2. Kaptaki Cu+2 iyonları da bu elektronları alarak Cu+2 + 2 e- –> Cu tepkimesine göre Cu çubuğun üzerinde toplanacak ve katotun kütlesi zamanla artacaktır.
Zn0 –> Zn+2 + 2e- Anot yarı tepkimesi (yükseltgenme) E0= 0,76 volt
Cu+2 + 2e- –> Cu0 Katot yarı tepkimesi (indirgenme)E0= 0,34volt —————————————————-
Zn + Cu+2 —> Cu + Zn+2 (pil tepkimesi) Epil =1,10volt
Tuz köprüsü Zn nun bulunduğu kapta zamanla pozitif yük fazlalığı ve Cu ın bulunduğu kapta da negatif yük fazlalığı olacaktır. Bu yükleri iyon akışıyla dengeleyebilmek için kurulan içi genellikle iyonik tuzların çözeltisiyle dolu olan bir sistemdir.
Pil gerilimi Elektron alıp verme eğiliminin ölçüsüne pil gerilimi denir.
Epil = Eanot + Ekatot
İki yarı pil tepkimesinin yükseltgenme potansiyelleri verildiği zaman potansiyeli büyük olan her zaman anot, küçük olan ise katot olacak şekilde tepkimeler düzenlenerek (küçük olan ters çevrilerek) pil tepkimesi ve potansiyeli hesaplanabilir.
* Bir tepkime ters çevrildiğinde E0 işaret değiştirir.
* Bir tepkime bir sayıyla çarpıldığında E0 bu sayıyla çarpılmaz, çünkü E0 pilin büyüklüğüne değil ortamdaki maddelerin derişimine bağlıdır.
Örnek Zn –> Zn+2 + 2e- E0 = 0,76 volt
Ag –> Ag+ + e- E0 = -0,80 volt
pil tepkimesi ve pilin potansiyeli ne olur ?
Çözüm Yükseltgenme gerilimlerine bakıldığı zaman Zn>Ag olduğu görülür. O zaman Zn anot (yükseltgenecek), Ag ise katot(indirgenecek). Zn tepkimesi aynen alınırsa yükseltgenme olur, Ag tepkimesi ters çevrilirse indirgenme olur. Redoks tepkimelerinde alınan elektron sayısı verilen elektron sayısına eşit olmalıdır. Bu yüzden Ag nin olduğu tepkime 2 ile çarpılmalı fakat E0 bu sayıyla çarpılmamalıdır.
Zn –> Zn+2 + 2e- E0 = 0,76 volt
2Ag+ + 2e- –> Ag E0= 0,80 volt
Zn + 2Ag+ –> Zn+2 + 2Ag Epil = 1,56 volt
*Yükseltgenme gerilimi büyük olan yükseltgenir, indirgenme gerlimi büyük olan indirgenir.
* Epil >0 ise pil kendiliğinden çalışır, küçükse çalışmaz.
* Elektron daima anottan katota doğru akar.
* Kütlesi azalan anottur.
* + yüklü iyonlar tuz köprüsü vasıtasıyla her zaman anottan katota doğru akar.
Derişim Pilleri Anot ve katotun aynı maddelerden yapılmış olduğu pillerdir. Derişimi büyük olan kap anot küçük olan ise katottur. Bu piller her iki kaptaki çözeltilerin derişimleri eşit oluncaya kadar çalışırlar, derişimler eşit olunca pil gerilimi sıfır olur.
e- akışı
Cr Cr
Anot Katot
2 M Cr+3 1 M Cr+3
Derişim pili
Elektroliz Kendiliğinden yürümeyen redoks tepkimelerinin dışarıdan enerji verilmesiyle gerçekleştirilmesine elektroliz denir. Elektroliz maddelerin saflaştırılmasında ve bileşiklerin elementlerine ayrıştırılmasında kullanılan kimyasal bir yöntemdir.
e- akış yönü + dan –
üreteç
+ –
Anot Cl- Na+ Katot
2Cl- –> Cl2 + 2e- Na+ + e- –> Na
Şekilden de görüldüğü gibi anyonlar anoda, katyonlar katoda giderek açığa çıkmaktadır. Eğer ortamda su varsa suyunda elektroliz olacağı unutulmamalıdır. Suyun elektrolizinde anot ve katot reaksiyonları aşağıdaki gibidir.
Anot reaksiyonu : 2H2O –> 4H+ + O2(g) + 4e-
Katot reaksiyonu : 2H2O + 2e- –> H2(g) + 2OH-
Bir tepkimede 1 Faradaylık akım 1 eşdeğer ağırlıkta madde açığa çıkarır.
1 Faraday 1 mol elektron= = 96500 coulomb dur.
Eşdeğer Ağırlık = Atom ağırlığı/ etki değeri
Örnek 1 Faradaylık akımla NaCl çözeltisi elektroliz edilse açığa çıkan Na miktarı = 23/1 = 23 gram .(Na=23)
Örnek 0,5 Faradaylık akımla CuCl2 çözeltisi elektroliz edilse( Cu=64) 1 Faraday = 64/ 2=32 gram.
1 Faraday 32 gram açığa çıkardığına göre 0,5 Faraday 16 gram Cu açığa çıkarır.
* Aktif olan element daima kendinden daha az aktif olan elementi serbest hale geçirebilir.
M= Q= I.t 96500.n
ASİDİK VE BAZİK ORTAMLARDA REDOKS TEPKİMELERİNİN DENKLEŞTİRİLMESİ
Redoks reaksiyonları elektron alış verişi olan reaksiyonlardır. Bunlara yükseltgenme – indirgenme reaksiyonları da denir. Böyle reaksiyonlarda, genellikle elektronun verildiği ve alındığı elementi bulmak için söz konusu reaksiyona giren her elementin yükseltgenme basamağının bilinmesi gerekir.
1- Oksijen bir kaç istisnayla ( OF2, H2O2, KO2 de -1) bütün bileşiklerinde -2 değerlik alır.
2- Hidrojen bir kaç istisnayla ( CaH2, UH3 de -1 ) bütün bileşiklerinde +1 yükseltgenme basamağındadır.
3- Flor bütün bileşiklerinde -1 yükseltgenme basamağındadır.
4- Cl, Br, I, oksijenli ve kendi aralarında verdikleri bileşikler hariç, bütün bileşiklerinde -1 yükseltgenme basamağındadır.
5- Alkali ¤¤¤¤ller (1A) +1, Toprak alkali (2A) ¤¤¤¤ller +2 yükseltgenme basamağında bulunurlar.
6- Elementlerin yükseltgenme basamakları sıfırdır.
7- İyonların yükü yükseltgenme basamaklarının topl***** eşittir.
8- Moleküllerde yükseltgenme basamakları toplamı sıfırdır.
Asidik Ortamda İyonik Redoks Tepkimelerinin Denkleştirilmesi :
1- İskelet reaksiyon üzerinde elementlerin yükseltgenme basamakları tayin edilir.
2- Alınan ve verilen elektron sayıları belirlenir.
3- Redoks reaksiyonlarında alınan elektron verilen elektrona eşit olduğundan elektron sayıları uygun sayılarla çarpılarak eşitlenir.
4- Yukarıda bulunan sayılar ilgili bileşik yada elementlere katsayı olarak yazılır.
5- Redoks reaksiyonlarında atom sayılarının denkliğinden başka yük denkliğinin de korunması gerekir. Bunun için de uygun tarafa H+ iyonu oksijenin eksik olduğu tarafa da H2O eklenmelidir.
ÖRNEKLER
3×2 elektron
+6 +3 +5
1. Cr2O7-2 + NO2-1 –> NO3-1 + Cr+3 (asidik ortam)
Cr2O7-2 + 3NO2-1 –> 3 NO3-1 + 2Cr+3
Yük denkliği -2 + (-1.3) = -5 -3 + (2.3)= +3
Yük denkliğinin sağlanabilmesi içn sol tarafa 8 mol H+ iyonun eklenmesi gerekir ki sol tarafta +3 olsun. Sağ tarafa da oksijen denkliği için 4 mol H2O eklenmelidir.
8 H+ + Cr2O7-2 + 3NO2-1 –> 3NO3-1 + 2 Cr+3 + 4H2O
+7 -1 +2 0
2. MnO4-1 + H2O2 –> Mn+2 + O2 (bazik ortam)
İndirgenme yükseltgenme İndirgenme yükseltgenme ==>5 indirgenme; 2×1 yükseltgenme
2MnO4-1 + 5H2O2 –> 2 Mn+2 + 5O2 Yük denkliği ==>-2= 2×2 (denkliğin sağlanabilmesi için sağ tarafa 6OH- sol tarafa ve hidrojen oksijen denkliği için 2H2O eklenmelidir)
2MnO4-1 + 5H2O2 –> 2 Mn+2 + 5O2 + 6OH- + 2H2O
No related posts.

Bu yazı yorumlara kapatılmıştır.