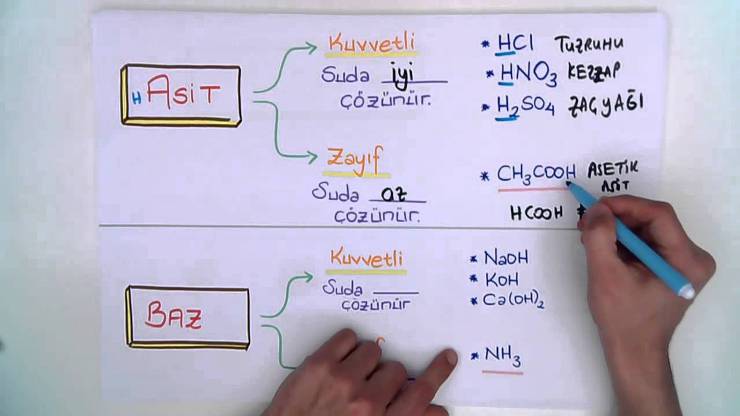
ASİTLER
Asitler, çözeltiye hidrojen iyonu bırakan bileşiklerdir. Bütün asitler hidrojen (H+) içerir. Genelde;
1- Ekşi bir tada sahiptirler.
2- İndikatörlerin rengini değiştirirler. (Asitler litmus kağıdını kırmızıya çevirirler).
3- Bazlarla reaksiyona girdiklerinde tuz ve su oluştururlar. Bundan başka çok çeşitlilik gösteren başka özellikleri de bulunur. Bu spesifik özellikler, anyon muhtevası ve ayrılmamış molekülerden dolayı olur. Çeşitli asitlerin molekülleri, çözeltiye farklı miktarda serbest Hidrojen bırakma eğilimindedirler.
Hidroklorik asit (güçlü asit)
HCI H + CI –
Asetik asit (zayıf asit)
C2 H4 O2 (CH3COOH)
Asetik asit; (sirke) zayıf iyonize olur ve serbest oksijenden az miktarda çözeltiye bırakır. Güçlü asit ve bazlar iyonlarına ayrılır ve ayrılmış halde bulunur. Bu asit olarak tek yönlü ok ile ifade edilir. Zayıf asit ve bazlar sürekli olarak iyonizasyon prosesi altındadırlar. Serbest iyonlar sürekli olarak tekrar kombine olurlar. Bu durum çift yönlü ok ile belirtilir.
Asidik olan bir su asit nötralizerleri ile arıtılır. Su asidik ise geçtiği yerlerde zamanla mavi-yeşil lekeler ortaya çıkar. pH testleri ile suyun asidik olup olmadığı anlaşılabilir.
Asit nötralizer olarak kalsit kullanıldığı zaman suya karışan çözünmüş kireç taşları su sertliğinin artmasına neden olur.
Soda veya sodyumhidroksit ile de pHyükseltilebilir.
BAZLAR
Bazlar, hidroksit iyonu bırakan maddelerdir. Örnek olarak Sodyum hidroksit (NaOH) ve amonyum hidroksit (NH4OH) verilebilir.
Sodyum hidroksit,
Na OH Na + + OH –
Amonyum hidroksit,
NH4OH NH4+ + OH –
Genelde;
1- Acı tada sahiptirler.
2- Kaygan hissiyatı verirler.
3- İndikatörlerin rengini değiştirirler. (Litmus kağıdını mavi yaparlar).
Amonyum hidroksit, zayıf bir bazdır ve çökeltiye az miktarda hidroksit iyonu bırakırlar. Güçlü baz ve zayıf baz durumu da asitlerde olduğu gibidir
No related posts.
Bu yazı yorumlara kapatılmıştır.